Ejercicio 2: Evaporador considerando entalpía de dilución#
Enunciado#
Un evaporador de un efecto es utilizado para concentrar \(9070~\text{kg/h}\) de una solución al \(20~\%\) de hidróxido de sodio hasta alcanzar un \(50~\%\) de concentración másica. La presión de manométrica del vapor saturado que entra al evaporador (\(\text{S}\)) es de \(1.37~\text{atm}\); la presión en el evaporador es \(100~\text{mmHg}\). Asuma que el coeficiente global de transferencia de masa es de \(1400~\text{W/m}^2\cdot\text{°C}\), y que la temperatura del flujo de alimentación es de \(37.8~\text{°C}\).
Encuentre lo siguiente:
El flujo másico de vapor saturado que sale del evaporador en la corriente \(\text{V}\).
El flujo másico de vapor saturado necesario en la corriente \(\text{S}\).
La economía del evaporador.
El área de evaporador requerido si la temperatura de condensación del vapor a \(1.37~\text{atm}\) es \(126.1~\text{°C}\).
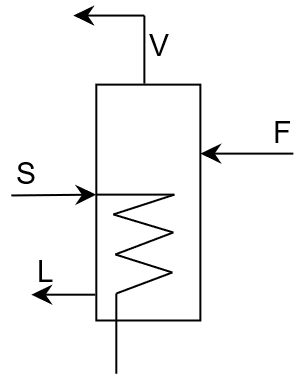
Fig. 13 Diagrama de evaporador de 1 efecto.#
Para sus cálculos utilice la siguiente información:
Temperatura de ebullición del agua a \(100~\text{mmHg}\): \(51.11~\text{°C}\)
Punto de ebullición de la solución a una concentración del \(20~\%\) de NaOH: \(91.67~\text{°C}\)
El calor latente de vapor saturado a \(1.37~\text{atm}\) es: \(2184.11~\text{kJ/kg}\)
La entalpía de agua sobrecalentada a \(91.67~\text{°C}\) puede ser calculada como:
Donde \(\Delta\text{EPE}\) es la elevación del punto de ebullición.
Ya que tenemos una solución salina, debemos considerar la entalpía de dilución. Para esto, utilice el siguiente gráfico.
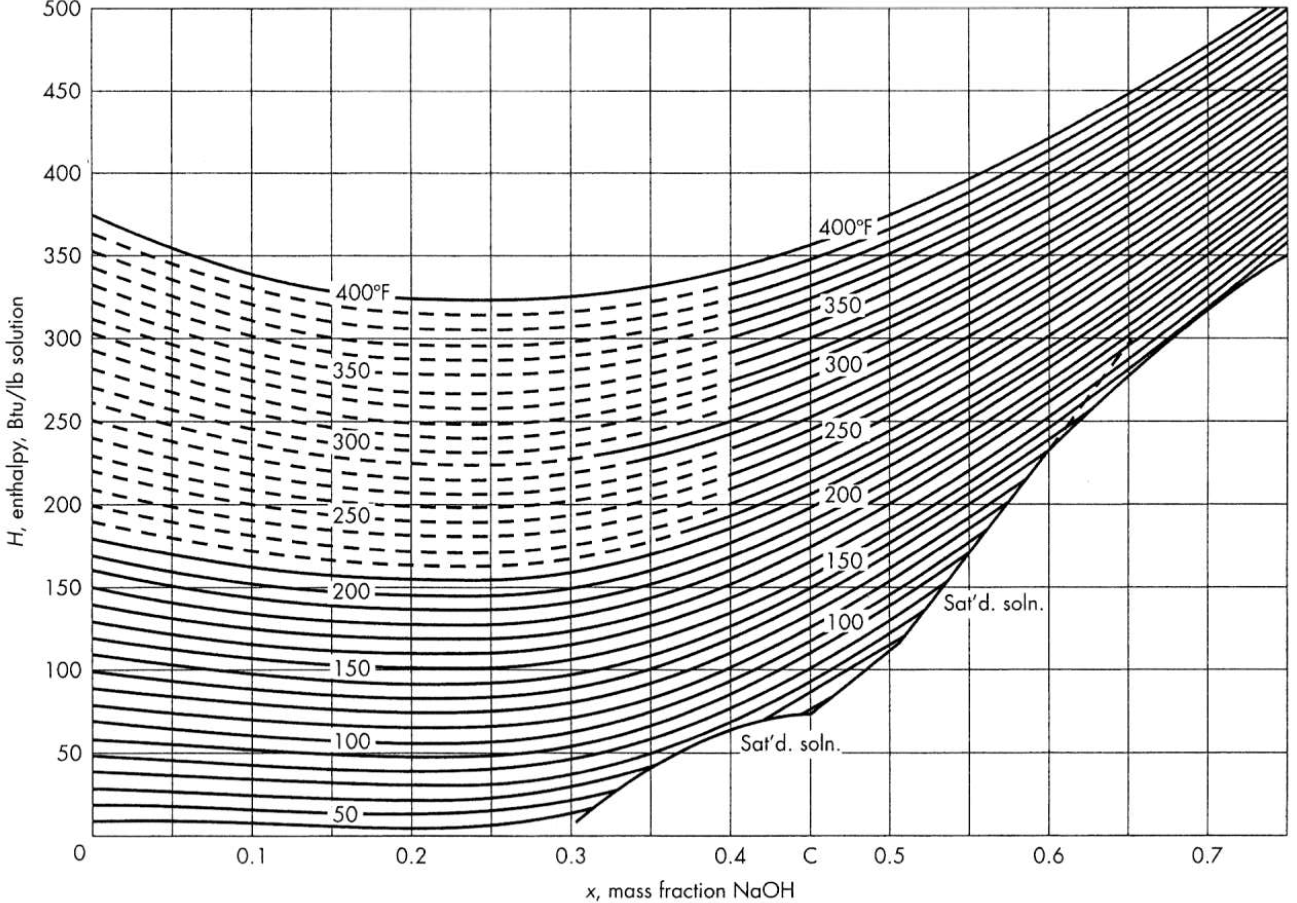
Fig. 14 Diagrama concentración másica vs entalpía.#
Solución#
Inciso 1#
import handcalcs.render
handcalcs.set_option("custom_symbols",{"dEPE": "\Delta EPE", "dotm": "\dot m", "lambda": "\lambda", "Tebs": "T^eb", "dT": "\Delta T"})
Se debe cumplir la conservación de masa, tal que
%%render params
dotm_F = 9070 #kg/h
w_F = 0.2
w_L = 0.5
%%render short
dotm_L = dotm_F*(w_F/w_L) #kg/h
Por balance de masa se despeja \(\dot{m}_V\).
%%render short 0
dotm_V = dotm_F-dotm_L #kg/h
Inciso 2#
Se debe despejar \(\dot{m}_s\) a partir del balance de energía.
%%render params
Tebs_sol = 91.67 #$^\circ$C
Tebs_w = 51.11 #$^\circ$C
lambda_s = 2184.11 #kJ/kg
Por definición, el \(\Delta\text{EPE}\) es la diferencia entre las temperaturas de ebullición de la solución y el agua pura. Ya que la fórmula para \(H_v\) se encuentra en función de la temperatura en Farenheit, hacemos el cambio de unidades.
%%render short 0
Tebs_solF = Tebs_sol*9/5 +32 #$^\circ$F
Tebs_wF = Tebs_w*9/5 +32 #$^\circ$F
dEPE = Tebs_solF-Tebs_wF #$^\circ$F
H_V = 1116+0.45*dEPE #Btu/lb
Las otras entalpías las encontramos de forma gráfica:
\(H_F:~20~\%~\text{sólidos a}~100~\text{°F}\) \(\rightarrow\) \(55~\text{Btu/lb}\)
\(H_L:~50~\%~\text{sólidos a}~197~\text{°F}\) \(\rightarrow\) \(221~\text{Btu/lb}\)
%%render short
H_V = 1149*2.326 # kJ/kg
H_F = 55*2.326 # kJ/kg
H_L = 221*2.326 # kJ/kg
%%render long
q = dotm_V*H_V + dotm_L*H_L - dotm_F*H_F # kJ/h
dotm_s = q/lambda_s #kg/h
Inciso 3#
%%render 2
E = dotm_V/dotm_s #kg/kg
Inciso 4#
La ecuación de diseño de un evaporador será:
Donde la diferencia de temperaturas \(\Delta T\) será la temperatura en el flujo de vapor \(\text{S}\) y la temperatura de ebullición de la solución en el evaporador.
%%render long
U = 1400 #W/m$^2\cdot^\circ$C
q = q*(1000/3600) #W
dT = 126.1-91.67
A = q/(U*dT) #m$^2$
